¿Tienes sed?¿Quieres bañarte?¿quieres un buen caldo de pollo?...
Todas estas preguntas tienen algo en común, el agua. Es una sustancia química con la que convivimos día a día, con la que no podemos vivir sin ella.
El agua, aunque nos resulte un líquido común, realmente no es tán común como parece ser. Comenzaremos a ver este líquido desde un punto de vista distinto al que estamos acostumbrado.
A los más pequeños les enseñan el agua como un líquido "amigo", que es indispensable para nuestra buena salud, como un líquido inocente.
No es tan alejado de la realidad, pero, podemos explicar un comportamiento muy extraño y desconocido que esconde el agua para las personas que están alejadas de la química.
Los expertos podemos llamar Óxido de hidrógeno u Oxidano, a lo común mente denominado Agua. Tiene como fórmula H2O, y sus propiedades son las siguientes:
Fórmula molecular nos muestra que tiene dos átomos de hidrógeno y un átomo de oxígeno.
A partir de la forma molecular podemos calcular fácilmente el peso (masa molecular). El átomo de hidrógeno 1g, mientras que el átomo de oxígeno 16g. Finalmente el agua pesa (2x1)g + 16g hace un total de 18g.
Los 18g nos hace ver un primer paso de lo especial que es el agua.
Comparativamente, el Metano, gas ciudad que llega a nuestras casas, tiene un peso de 16g. El metano es un gas, mientras que el agua es un líquido. Un fenómeno, que ahora mismo nos ha de resultar extraño a la par de sorprendente.
¿Qué la hace tan especial para que tenga un peso tan pequeño y está en estado líquido?
 La respuesta a esta pregunta es un comportamiento de los hidrógeno, de los que consta de dos en el agua. Este comportamiento, es el denominado, enlace de hidrógeno, este enlace se realiza entre un átomo de hidrógeno y cierto tipo de átomos como el oxígeno, de los cuales no están directamente unidos, y hace un tipo de unión entre moléculas que es fuerte.
La respuesta a esta pregunta es un comportamiento de los hidrógeno, de los que consta de dos en el agua. Este comportamiento, es el denominado, enlace de hidrógeno, este enlace se realiza entre un átomo de hidrógeno y cierto tipo de átomos como el oxígeno, de los cuales no están directamente unidos, y hace un tipo de unión entre moléculas que es fuerte.Este conjunto de uniones entre varias moléculas de agua, finalmente da como resultado una "compactación" que hace subir su punto de evaporación (temperatura a la cual va a evaporarse) hasta 100ºC.
Este enlace es tan fuerte que moléculas de igual peso como el metano (16g), mayor peso, incluso como el CO2 (dióxido de carbono) (64g), no realizan enlaces de hidrógeno y tienen un punto de ebullición mucho más bajos. Son gases.
Además del estado de agregación (forma de presentarse: solido, líquido o gas)
¿Qué más tiene de especial el agua?
 El agua tiene, al igual que otros líquidos, una densidad que a 4ºC es de 1g/ml, es decir, que si pesamos con una balanza 1ml de agua, esta debiera de marcar 1g.
El agua tiene, al igual que otros líquidos, una densidad que a 4ºC es de 1g/ml, es decir, que si pesamos con una balanza 1ml de agua, esta debiera de marcar 1g.Pero, al igual que la mayoría de los líquidos, la experiencia nos dice que al calentarlo se dilata y al enfriarlo se contrae.
En el caso del agua, no hace lo que la experiencia nos dice. Cuando el agua se congela, se dilata, es decir, aumenta su volumen.
Por lo que la densidad del agua no corresponde a un valor uniforme, sino al valor máximo de densidad del agua, que corresponde a 3,98ºC.
Gracias a la dilatación anómala del agua es posible la vida en los ecosistemas acuáticos.
En un lago de montaña, por ejemplo, al llegar el invierno, el agua se congela. Pero como el hielo flota, solo se congela una delgada capa de agua, que queda en la superficie. El agua por debajo está muy fría, pero el hielo la aísla de las bajas temperaturas del exterior y así no llega a congelarse. Gracias a esto, las plantas y los animales acuáticos pueden sobrevivir en invierno.
En la naturaleza, normalmente, siempre hay agua líquida bajo el hielo.
Todo esto hace que el agua sea una molécula muy especial. Tanto que presenta formas especiales para la supervivencia de especies biológicas como seres humanos, peces, aves, etc...
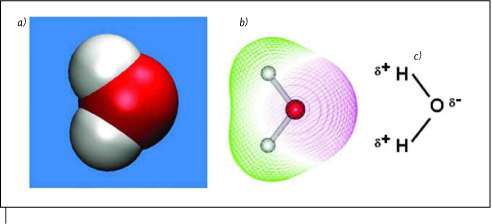
Ahora os muestro el aspecto real de la molécula de agua:
La primera (a) es la forma de "esferas" en la que, está representado en rojo el oxígeno y en blanco, los hidrógenos. Podemos observas que es una molécula y angular. en la segunda parte (b), vemos la angularidad de la molécula mucho mejor. En la tercera parte (c), vemos, que la molécula de agua es polar y es gracias a eso que puede hacer, lo mencionado anteriormente como enlace de hidrógeno.
Tal vez o halla resultado un más técnico de lo que hubiera querido, pero espero haberos mencionado algunas cosas, que hubieren pasado desapercibidas para todos los lectores.
Si quieres más artículos como este, ayúdanos comentándolo y haciendo peticiones.
Gracias por tu atención.











0 comentarios:
Publicar un comentario